禁忌を含む使用上の注意等はこちらをご参照ください。
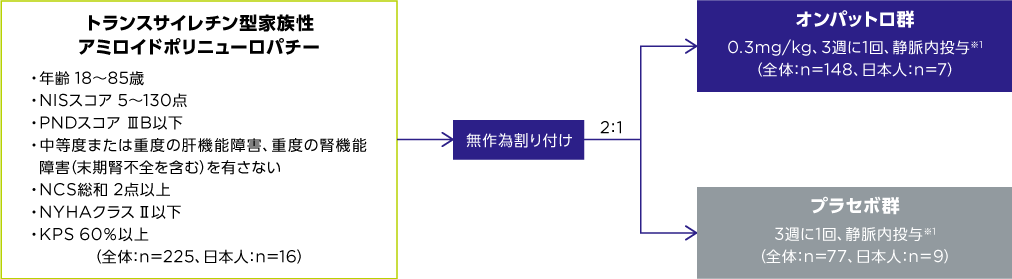
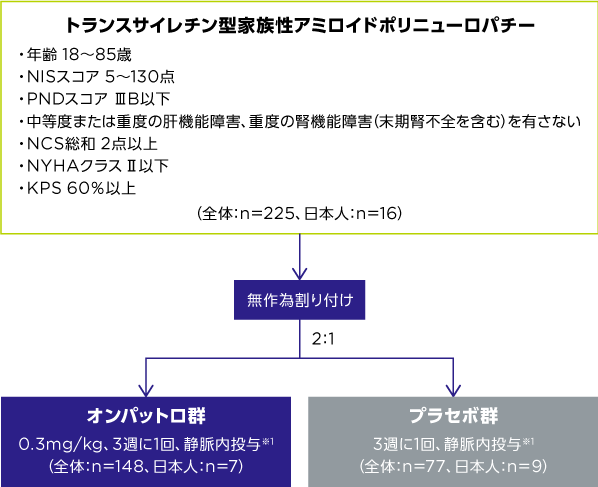
対象
成人トランスサイレチン型家族性アミロイドポリニューロパチー患者225例(日本人:16例)
- TTR変異が確認され、トランスサイレチン型家族性アミロイドポリニューロパチーと診断された患者
- NIS(Neuropathy Impairment Score)スコアが5~130点およびPND(Polyneuropathy Disability)スコアがⅢB以下
- 中等度または重度の肝機能障害、重度の腎機能障害(末期腎不全を含む)を有さない患者
- 腓腹の感覚神経活動電位(SNAP)、脛骨の複合筋活動電位(CMAP)、尺骨のSNAP、尺骨のCMAPおよび腓骨のCMAPのNCS総和が2点以上
- NYHAクラスがⅡ以下
- KPS※(Karnofsky Performance Status)が60%以上
試験方法
第Ⅲ相、多施設共同、ランダム化、二重盲検、プラセボ対照、国際共同試験
225例をオンパットロ群(n=148)またはプラセボ群(n=77)のいずれかに無作為に割り付け、オンパットロ(0.3mg/kg)もしくはプラセボ(0.9% NaCl)を3週に1回、最長78週間(18ヵ月間)静脈内投与(1回あたり約70分間かけて点滴静注)した。すべての患者に前投薬として、デキサメタゾン(または同等薬)、パラセタモール/アセトアミノフェン(または同等薬)、H1/H2拮抗薬を投与した。
なお、9ヵ月時点で、臨床判定委員会が盲検化された患者データをレビューし、急速な病勢進行(mNIS+7スコアのベースラインから24点以上の増加、かつ、FAPステージのベースラインからの進行)が認められたと判断した場合、治験薬の投与を中止した。
- NISスコア(50点未満、50点以上)
- TTR遺伝子型分類(若年発症V30M型、高齢発症V30M型を含むその他の全変異)
- TTR四量体安定化剤(タファミジスまたはジフルニサル※2)の使用歴(あり、なし)
評価項目
- 【主要評価項目】
-
投与18ヵ月時点のmNIS+7(modified Neuropathy Impairment Score+7、補正神経障害スコア+7)スコアのベースラインからの変化量のオンパットロ群とプラセボ群との差
- 【副次評価項目】
-
以下の項目における投与18ヵ月時点のベースラインからの変化量のオンパットロ群とプラセボ群との差
- Norfolk QOL-DN(Norfolk Quality of Life-Diabetic Neuropathy、糖尿病神経障害)スコア
- NIS-W(Neuropathy Impairment Score-Weakness、神経障害スコア-筋力低下)スコア
- R-ODS(Rasch-built Overall Disability Scale、身体障害尺度)スコア
- 10-MWT(10-Meter Walk Test、10メートル歩行試験)
- COMPASS 31(Composite Autonomic Symptom Score 31、複合自律神経症状スコア 31)スコア
- mBMI(modified Body Mass Index、補正BMI、体重(kg)/[身長(m)]2×血清アルブミン値(g/L))
- 【探索的評価項目】
-
以下の項目における投与18ヵ月時点のベースラインからの変化量のオンパットロ群とプラセボ群との差
- 血清中TTR濃度
- PND(Polyneuropathy Disability)スコア
- FAP(Familial Amyloid Polyneuropathy)ステージ
- 心エコーパラメータ(左室壁の厚さ、左室長軸方向ストレイン、左室拡張終期容積、心拍出量など)、ならびに心臓バイオマーカー[脳性ナトリウム利尿ペプチド前駆体N端フラグメント(NT-proBNP)、トロポニンI]など
- 【安全性】
-
有害事象、臨床検査、心電図(ECG)など
解析計画
- 【解析対象集団】
-
すべての有効性の解析はmITT集団を解析対象集団とし、安全性の解析は安全性解析対象集団とする。
- 【解析方法】
-
主な評価項目は、制限付き最大尤度に基づくMMRM(Mixed Model Repeated Measures:繰り返し測定混合効果モデル)法を用いて解析を行う。モデルには、共変量としてベースライン値を含め、また投与群、来院時期(9ヵ月、18ヵ月)、治療-来院の交互作用、TTR遺伝子型(V30M型、非V30M型)、トランスサイレチン型家族性アミロイドポリニューロパチー発症年齢(50歳未満、50歳以上)、地域(北米、西欧、その他の国または地域)、TTR四量体安定化剤の使用歴(あり、なし)などの固定効果の項を含める。Norfolk QOL-DNスコア、R-ODSスコア、10-MWT、mBMI、COMPASS 31スコアについては、MMRMにベースラインのNISスコア(50点未満、50点以上)も因子として含める。
副次評価項目は、Norfolk QOL-DNスコア、NIS-Wスコア、R-ODSスコア、10-MWT、mBMI、COMPASS 31スコアの階層順に検定し、両側0.05の有意水準での比較が有意であった場合のみ、次の階層の評価項目を正式に検定した。
- 【サブグループ解析】
-
mNIS+7スコアおよびNorfolk QOL-DNスコアについては、患者のベースライン特性に基づくサブグループ解析を行う。
日本人集団における有効性および安全性についても、全患者集団と同様の方法で解析する。
心アミロイドーシス集団を対象にアミロイド心筋症に及ぼす影響を評価する。